Презентация по физике - Молекулярная физика
Закон Дальтона
Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы при условии, если их растворимость невелика, а поведение близко к поведению идеального газа. Теоретическое нахождение давления смеси реальных газов является очень трудной задачей. Рассмотрим частный случай смеси неплотных неидеальных газов. Как известно, для таких газов уравнением состояния является уравнение Ван-дер-Ваальса:
(p+an2/V2 ) (V-nb) = nRT или p = nRT/(V-nb) - an2/V2,
где p, T, n - давление, температура и количество молей газа, соответственно, R - универсальная газовая постоянная, a и b - константы, характеризующие силы притяжения и отталкивания между молекулами газа. Для неплотных газов, когда nb<<V, можно записать вириальное разложение:
p = nRT/V + (bRT-a)n2/V2.
Видно, что давление реального газа отличается от давления идеального на величину, пропорциональную bRT-a, которая может быть как больше, так и меньше нуля (все определяется тем, какие силы между молекулами преобладают - отталкивания или притяжения). Допустим, мы смешиваем два неплотных реальных газа, у которых константы a и b идентичны (например, изотопы). Тогда:
p1 = n1RT/V + (bRT-a)n12/V2, p2 = n2RT/V + (bRT-a)n22/V2, pсм = (n1+n2) RT/V + (bRT-a)(n1+n2)2/V2,
где p1, p2, pсм - давление первого газа, второго газа и их смеси соответственно. Легко получить, что Dp = pсм - p1 - p2 = 2(bRT - a)n1n2/V2. Таким образом, при T > a/bR давление смеси газов будет больше суммы парциальных давлений, при T < a/bR давление смеси газов будет меньше суммы парциальных давлений, а при T = a/bR закон Дальтона будет выполняться.
Отто фон Генрике
Отто фон Генрике (20.11.1602-11.05.1686) - немецкий физик. Родился в Магдебурге. В 1617-1623 годах учился в Лейпцигском, Гельмштадском, Йенском и Лейденском университетах. В 1646-1678 годах - бургомистр Магдебурга.
Изобрел воздушный насос и, усовершенствовав его, осуществил ряд опытов: продемонстрировал в 1654 году существование давления воздуха (опыт с "магдебургскими полушариями"), доказал его упругость, определил плотность, выяснил, что воздух является проводником звука, в пустоте звук не распространяется и т.п. Около 1660 года Герике построил одну из первых электростатических машин. Это был шар, который мог вращаться вокруг железного стержня как вокруг оси. Вращая шар и натирая его ладонями, Герике тем самым электризовал его. С помощью этого прибора изучал электрические явления, в частности обнаружил явление электрического отталкивания, электризацию через влияние и электрическое свечение (наблюдал в темноте свечение наэлектризованного серного шара). Построил также первый водяной барометр (1657) и использовал его для предсказания погоды, изобрел гигрометр, построил воздушный термометр, манометр (не позже 1662).
Герике изучал магнитные явления, заметил намагничивание длинных железных предметов, расположенных при ковке в меридиональном направлении. Обратил внимание на уменьшение интенсивности света при отражении. Автор трактата "Новые, так называемые магдебургские опыты с пустым пространством" (1672). Доказал, что давление идеального газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объёма.
Отто Штерн
В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены скорости частиц вещества. Прибор Штерна состоял из двух цилиндров разных радиусов, закрепленных на одной оси. Воздух из цилиндров был откачан до глубокого вакуума. Вдоль оси натягивалась платиновая нить, покрытая тонким слоем серебра. При пропускании по нити электрического тока она нагревалась до высокой температуры, и серебро с ее поверхности испарялось. В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проникали движущиеся атомы металла, осаждаясь на внутренней поверхности внешнего цилиндра, образуя хорошо наблюдаемую полоску. Цилиндры начинали вращать с постоянной угловой скоростью. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. Зная величины радиусов цилиндров, скорость их вращения и величину смещения, легко найти скорость движения атомов. Если бы все атомы двигались с одинаковой скоростью, то при вращении установки полоска на стенке внешнего цилиндра получалась бы точно такой же тонкой, как и в случае, когда установка не вращалась. Однако при вращении полоска, образованная осевшими на стенку цилиндра атомами, оказывалась размытой. Значит скорости атомов были разными.
Уравнение Клапейрона - Менделеева
Уравнение состояния термодинамической системы представляет собой аналитическую формулу, связывающую параметры состояния системы. Если состояние системы может быть полностью описано с помощью трех параметров: давления P, объема Vи температуры T,то уравнение состояния в самом обычном виде будет выглядеть так: F(P,V,T)=0
Конкретный вид этой формулы зависит от физических свойств рассматриваемой термодинамической системы.
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым: уравнением Клапейрона-Мендилеева: PV=vRT
где: P- давление газа, V- занимаемый им объем, v- количество молей газа, R- универсальная газовая постоянная, T- абсолютная температура. Уравнение названо в честь французского физика Бенуа Поля Эмиля Клапейрона(1799 - 1864) и русского химика Дмитрия Ивановича Менделеева(1834 - 1907).
В рамках термодинамического подхода газ, уравнение состояния которого, связывающие параметрыP, V, иT, является уравнением Клапейрона-Менделеева называется идеальным газом. При нормальных условиях наиболее близкими по своим свойствам к идеальному газу являются водород и гелий.
Подробный анализ уравнения начнем с обсуждения величиныT, которая называется абсолютной температурой. Из формулы следует, что при постоянном объеме и количестве вещества температура Tпропорциональна давлению идеального газа P. А это означает, что если измерение температуры проводить с помощью газового термометра постоянного объема, в качестве рабочего тела в котором используется идеальный газ, то такой термометр будет иметь линейную шкалу температур. Очевидно, что использование газового термометра для определения абсолютной температуры ограничено, так как в качестве термометрического тела может быть использован только реальный газ, свойства которого отличны от идеального, и для которого уравнение является приближенным. При низких температурах реальный газ переходит в жидкое состояние, что делает невозможным его использование при этих температурах в качестве рабочего тела газового термометра.
Закон Бойля-Мариотта
Научная деятельность Роберта Бойля была основана на экспериментальном методе и в физике, и в химии, и развивала атомистическую теорию. В 1660 году Роберт Бойль открыл закон изменения объема газов (в частности, воздуха) с изменением давления. Позднее он получил имя закона Бойля-Мариотта: независимо от Бойля этот закон сформулировал французский физик Роберт Мариотт. Кроме того, Бойль доказал, что при изменении давления могут испаряться даже те вещества, с которыми этого не происходит в нормальных условиях, например лед. Бойль первым описал расширение тел при нагревании и охлаждении. Бойль сомневался в универсальной аналитической способности огня и искал иные средства для анализа. Его многолетние исследования показали, что, когда на вещества действуют теми или иными реактивами, они могут разлагаться на более простые соединения. Бойль изобрел оригинальную конструкцию воздушного насоса. Насосом удалось почти полностью удалить воздух. Пустое пространство он решил назвать вакуумом, что по-латыни означает "пустой".Бойль много занимался изучением химических процессов -- например, протекающих при обжиге металлов, сухой перегонке древесины, превращениях солей, кислот и щелочей. В 1654 году он ввел в науку понятие анализа состава тел. Одна из книг Бойля носила название "Химик-скептик". В ней были определены элементы - как "первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены". А в 1661 году Бойль формулирует понятие о "первичных корпускулах" как элементах и "вторичных корпускулах" как сложных телах. Он также впервые дал объяснение различиям в агрегатном состоянии тел. В 1660 году Бойль получил ацетон, перегоняя ацетат калия, в 1663 году обнаружил и применил в исследованиях кислотно-основный индикатор лакмус в лакмусовом лишайнике, произрастающем в горах Шотландии. В 1680 году он разработал новый способ получения фосфора из костей, получил ортофосфорную кислоту и фосфин.В Оксфорде Бойль принял деятельное участие в основании научного общества, которое в 1662 году было преобразовано в Лондонское Королевское общество (фактически это английская Академия наук).Бойлем было написано множество книг, некоторые из них вышли в свет уже после смерти ученого. Для газа данной массы при постоянной температуре произведение давления газа на его объём постоянно: p1V=p2V2
Амедео Авогадро
Закон Авогадро в современном виде звучит так: "Моль любого вещества в газообразном состоянии при одинаковых температурах и давлениях занимает один и тот же объем" (масса одного моля вещества пропорциональна его молекулярному весу). Авогадро доказал, что в моле любого вещества содержится всегда одно и то же число молекул (число Авогадро NA=6.02*1023)
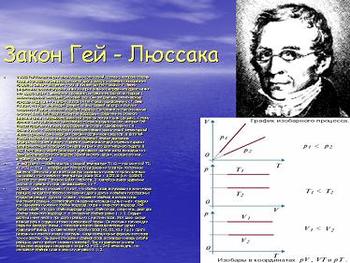
Закон Гей - Люссака
В 1808 Гей-Люссак открыл закон объёмных отношений, согласно которому объемы газов, вступающих в реакцию, относятся друг к другу и к объемам газообразных продуктов реакции как целые числа. В том же году Гей-Люссак и Л. Тенар разработали способ получения калия и натрия сильным нагреванием едкого калия или едкого натрия с железными стружками; нагреванием борного ангидрида с калием выделили свободный (нечистый) бор. Они же доказали элементарную природу хлора, калия и натрия. В 1813-14 Гей-Люссак одновременно с Г. Деви показал, что йод - химический элемент, очень похожий на хлор, и получил соединения йода, в частности йодистый водород. Приготовив чистую синильную кислоту (1811), Гей-Люссак признал её водородным соединением сложного радикала циана. Нагреванием цианистой ртути он получил циан (дициан). К этому времени было установлено существование бескислородных кислот, которые Гей-Люссак предложил называть водородными кислотами. Одновременно с И. Берцелиусом и И. Дерберейнером усовершенствовал органический элементарный анализ, применив окись меди для сжигания органических веществ. В 1819 Гей-Люссак построил на основании своих определений первые диаграммы растворимости солей в воде и подметил существование двух отдельных кривых растворимости для безводного сульфата натрия и его десятиводного гидрата. В 1827 Гей-Люссак изобрёл башню для улавливания окислов азота, выходящих из свинцовых камер при производстве серной кислоты. Башни, носящие его имя, впервые применены в
+ adT),где v1 — объём газа при исходной температуре T1; v2 — при конечной T2; dT = T2 — T1; a — коэффициент теплового расширения газов при постоянном давлении. Величина a для всех газов при нормальных условиях приблизительно одинакова и при измерении температуры газа в 0С a = 1/273,15 (или 0,00367). Сочетая этот закон с законом Бойля—Мариотта, Э. Клапейрон вывел уравнение состояния идеального газа, связывающее р, v и Т.
2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции. Другими словами, отношение объёмов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел. Измеряя при одинаковых условиях объёмы водорода, хлора и хлористого водорода, Гей-Люссак нашёл, что один объём водорода и один объём хлора, соединяясь, дают два объёма хлористого водорода, т. е. отношение объёмов равно 1: 1: 2. Сходная картина имеет место и при других реакциях с участием газов. Этот закон сыграл важную роль в создании атомно-молекулярной теории. Он послужил толчком для открытия Авогадро закона, с помощью которого Авогадро впервые сделал правильный вывод о составе молекул простых газов (H2, Cl2, N2 и т.д.) и строго разграничил понятия атома и молекулы. Когда молекулярные формулы всех газов точно известны, отыскание отношения объёмов газов, вступающих между собой в реакцию, уже не требует сложных измерений. Так, из уравнения синтеза хлористого водорода из водорода и хлора Н2 + Cl2 = 2HCl легко видеть, что отношение объёмов газов в этом случае равно 1: 1: 2.
Закон Шарля
Один из основных газовых законов, согласно которому давление данной массы идеального газа при постоянном объёме меняется линейно с изменением температуры:
pt=p0(1+Bt), где pt p0- давление газа при температуре t и 0 С соответственно, B=1/273.17k- температурный коэфицент давления. Установлен в 1787г. французским учёным Ж. Шарлем (1746-1823)
Скачать - Презентация по физике - Молекулярная физика
Дата публикации:
Теги: презентация :: физика :: презентация по физике :: молекулярная физика :: Демокрит :: Закон Дальтона :: Отто фон Генрике :: Отто Штерн :: Уравнение Клапейрона - Менделеева :: Закон Бойля-Мариотта :: Амедео Авогадро :: Закон Гей - Люссака :: Закон Шарля :: скачать :: бесплатно :: 5-11 класс
Смотрите также учебники, книги и учебные материалы:
Следующие учебники и книги:
- Презентация - Закон Ома для участка цепи
- Презентация - Радиолокация
- Презентация - Теория Кристаллического Поля - ТКП
- Презентация - Теория относительности - Новые преобразования
Предыдущие статьи:
- Презентация по физике - Что могут нанотехнологии?
- Презентация по физике - Гром и молния - Загадки природы
- Презентация по физике - Теория относительности и Альберт Эйнштейн
- Презентация по физике - Квантовая физика
